
蔡昀杉 綜合報導 / 台北市
自高端新冠肺炎疫苗採購合約公布以來,引發外界高度關注,如今卻傳出「高端疫苗只在第一批批號出來後做檢驗」一事,今(18)日食藥署發文澄清,每批新冠肺炎疫苗輸入台灣,都會依藥事法第74條辦理生物藥品檢驗封緘,都會進行逐批查核、抽樣、檢驗、審查等程序,審查合格後才會封緘放行。
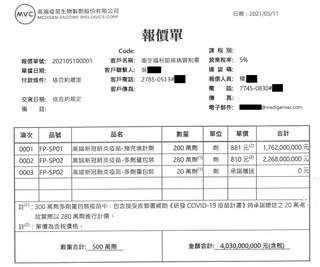
高端新冠肺炎疫苗自疫情期間就備受討論,日前衛福部疾管署正式公開高端新冠疫苗合約與契約內容,仍無法平息質疑。如今傳出「高端疫苗只在第一批批號出來後做檢驗」,食藥署今(18)日回應,食藥署共受理高端公司申請45批、566萬4743劑新冠肺炎疫苗檢驗封緘案,每批疫苗都有逐批檢查,經檢驗與審查合格後,才會核發封緘證明書放行封緘。
另外,食藥署也強調根據藥事法74條規定,依據微生物學、免疫學學理製造之血清、抗毒素、疫苗、類毒素及菌液等,非經中央衛生主管機關於每批產品輸入或製造後,派員抽取樣品,經檢驗合格,並加貼查訖封緘,不得銷售。
食藥署表示,自110年3月第1批新冠肺炎疫苗輸入台灣,食藥署均依據藥事法第74條辦理生物藥品檢驗封緘,包含AstraZeneca、Moderna、BioNTech、Novavax及高端公司生產之新冠肺炎疫苗,均進行逐批查核、抽樣、檢驗、審查等程序,查合格後才會封緘放行。
新聞來源:華視新聞

















讀者迴響