中央社 / 台北市
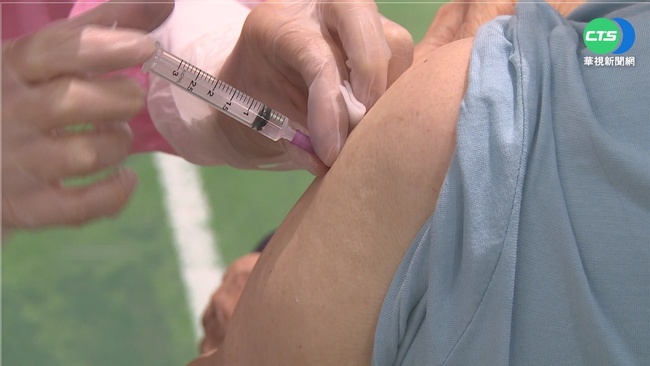
(中央社記者陳婕翎台北26日電)高端疫苗2期臨床試驗遭指委託疑涉中資丘以思公司執行,衛福部長薛瑞元今天回應,丘以思母公司是今年10月公布合併中資,不排除重啟藥品臨床試驗GCP可能,確保臨床試驗資料保存。
台灣民眾黨立委邱臣遠24日在立法院社會福利及衛生環境委員會質詢時,質疑高端公司委託執行第2期臨床試驗的「丘以思生技顧問公司」涉中資,對此,衛福部食藥署昨天晚間發布新聞稿指出,經查丘以思合法立案,且高端公司對試驗數據的品質與完整須負完全責任。
薛瑞元今天上午出席台灣失智症協會舉辦的全國失智症行動成果發表會,會前接受媒體聯訪時,被問及此事,他解釋,高端公司在做第2期臨床試驗時,委託CRO(受託研究機構)公司協助臨床試驗,就是簽約丘以思生技,經查仍然是台灣登記委案公司,為一間美商子公司。
薛瑞元說,丘以思母公司是今年10月公布合併中資,這在業界很常見,此後,台灣子公司並沒有變,丘以思生技仍然是經濟部允許合法登記的港資公司。丘以思生技目前也接受台大醫院許多委託,這次只是高端委託的臨床試驗機構背後母公司合併中資,高端並無開先例,是行之有年合作模式。
薛瑞元強調,衛福部注重的是藥品臨床試驗GCP(藥品優良臨床試驗準則,Good Clinical Practice,GCP),包含高端COVID-19(2019冠狀病毒疾病)疫苗2期臨床試驗委託的CRO公司是否為台灣經濟部核准的合法登記公司,以及臨床試驗是否按部就班正常執行,查核試驗數據妥善保存與否,不會涉及背後母公司股東結構變化。
薛瑞元表示,高端疫苗二期臨床試驗去年6月藥品臨床試驗GCP合格,國產疫苗個資保存屬於GCP查核範疇,當初並無發現異常,高端疫苗緊急使用授權(EUA)則在去年7月通過。丘以思母公司合併中資後,若食藥署評估有必要再次確認資料保存狀況,並不排除重啟GCP可能性。
針對媒體質疑中央對高端及BNT中資議題雙標,薛瑞元重申,當初復必泰是涉及輸入疫苗申請,今天談及的丘以思母公司只是高端的臨床試驗委託,經查丘以思母公司並無與高端簽約前就合併一事,更不是代表高端被中資合併,強調CRO公司海外母公司背後股權變化不是衛福部查核範圍內。(編輯:陳政偉)1111026
新聞來源:中央社



















讀者迴響