
王婕秋 綜合報導 / 台北市
衛福部日前核准高端疫苗生產製造,同時也開放民眾填寫高端疫苗意願登記,食藥署今(2)日也公布,4批高端疫苗(MVC COVID-19 Vaccine)共26萬劑已完成封緘檢驗,將投入疫苗接種計畫。不過疫苗封緘檢驗須約30天的時間,高端於7月18日才通過EUA,因此被質疑是否在EUA審查之前,高端就已先行封緘檢驗。對此,指揮中心指揮官陳時中在今日記者會上也進行說明。
高端遭質疑「偷跑」封緘 陳時中這樣說
高端疫苗在7月18日才通過緊急使用授權(EUA),但今日食藥署卻公布,4批高端疫苗已完成封緘檢驗,前後不到規定所須的時間30天,因此遭到外界質疑「偷跑」。對此,陳時中則解釋,「在法規允許的範圍協助行政程序縮短,才能加速研發;同時透過預採購分擔疫苗商的風險,再啟動試量產」,不過陳時中也強調「EUA如果沒過,或者EUA過了但檢驗不合格,政府同樣不會放行」、「不會因為已經量產了就讓它(高端檢驗封緘)過」。
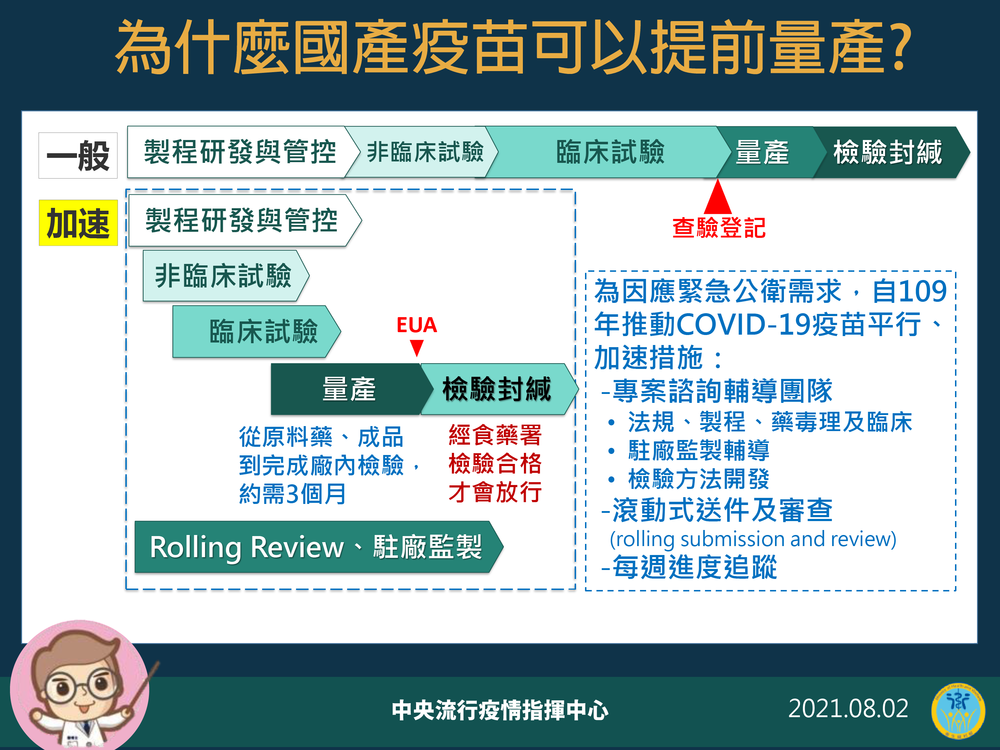
陳時中說明,一般疫苗研發的過程,起自製程研發與管控、非臨床試驗、臨床試驗、量產,最後才是檢驗封緘。不過在因應公共衛生緊急事件的需求下,陳時中表示,「為加速疫苗研發,國內去年以專案成立輔導團隊,針對疫苗或新藥試驗等EUA進行專案輔導計畫,同時進行滾動式送件及審查和每週進度追蹤」、「EUA會要求先做出產品」。
陳時中也指出,若是依照過去的情形,EUA審查、查驗登記過後才開始量產,需要3到4個月甚至半年不等的時間,「這樣EUA就失去意義」。
高端何時開放施打? 陳時中:待產量至少50至60萬
至於高端疫苗何時可以開打?陳時中表示,「只要能確定高端疫苗的供貨時程和數量,就能配合預約平台逐步釋出」。但陳時中也指出,只有20多萬劑要開打可能在排定、分配上會出問題,等到產量有基本的定量,約50萬至60萬後才會進行施打。
新聞來源:華視新聞



















讀者迴響