雷雅 李鴻杰 報導 / 台北市
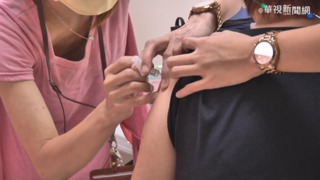
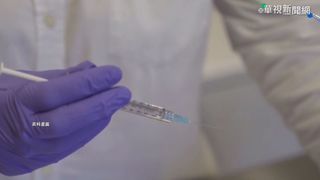
全球都在積極研發新冠疫苗,台灣有三家疫苗廠進入第一期人體臨床試驗,要是順利將會在今年年底申請進入第二期臨床試驗,不過衛福部食藥署訂出緊急授權條件,要求所有疫苗廠在第二期臨床試驗人數,從一千三百人提高到三千人,並且要追蹤一個月,確認安全性與有效性,如果都符合標準,就可以拿到授權量產上市,但是後續仍要繼續完成第三期臨床試驗。
新冠疫苗生產馬不停蹄,台灣三家疫苗廠高端、聯亞、國光,全都進入了第一期人體臨床試驗階段,要是順利可望在12月申請進入第二期臨床試驗,不過原先要求第二期受試者只需要1300人,現在食藥署決定參照美國緊急授權指引,將受試人數調高到3000人,食藥署藥品組副組長吳明美說:「施打疫苗受試疫苗的人數,最少要三千人以上,不包含這個安慰劑組的部分,打完了第二劑之後,要再追蹤至少一個月,看它的安全性。」
如果完成第二期臨床試驗後,疫苗的安全性與有效性都達到標準,就能通過緊急授權上市,可先量產一百萬劑疫苗,但後續仍要同步進行第三期臨床試驗,才能取得藥證繼續生產,只是二期臨床試驗人數增加一倍,也可能打亂了疫苗廠的進度,疫苗廠業者陳燦堅說:「會把原來要跟國外,以及國內合作的兩項實驗加緊合併,更集中在台灣加緊收案,但是我們也不排除跟國外緊密的合作。」根據目前的計畫,如果三家疫苗廠都通過了緊急授權,明年第二季台灣可望有三百萬劑新冠疫苗,優先給醫療及防疫人員,約150萬人施打。
新聞來源:華視新聞


















讀者迴響