
朱培妤 綜合報導 / 台北市
台灣本土疫情嚴峻,許多人也相當關心疫苗進度;衛福部疾管署昨(30)日證實,已和高端、聯亞2家國產疫苗廠簽約,卻受到外界質疑,2家國產疫苗藥廠的COVID-19疫苗都還在第2期臨床實驗,是否會有安全疑慮?對此,指揮官陳時中以國際4大疫苗廠牌的試驗人數做出比較,並強調,「各國通過疫苗緊急使用授權時間,也都是三期沒做完,若等到三期完畢,恐怕是緩不濟急」。
國產疫苗未做三期試驗有安全疑慮?陳時中說明
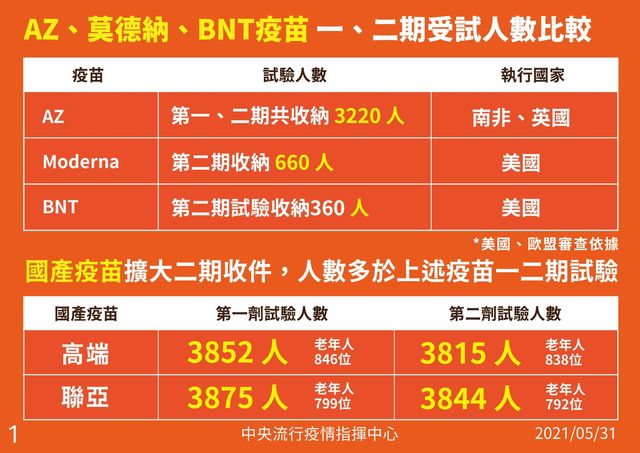
針對國產疫苗安全性議題,陳時中說明,以做一、二期的受試人數比較,國內進行一、二期試驗中,包含老年人口在內都將近四千人,顯然規模皆比國外一、二期試驗人數還多,是擴大執行,可以視為一個二、三期延續計畫,以這樣規模,二期做的是安全性,以這樣的規模如果能通過的話,安全性就不會有問題。
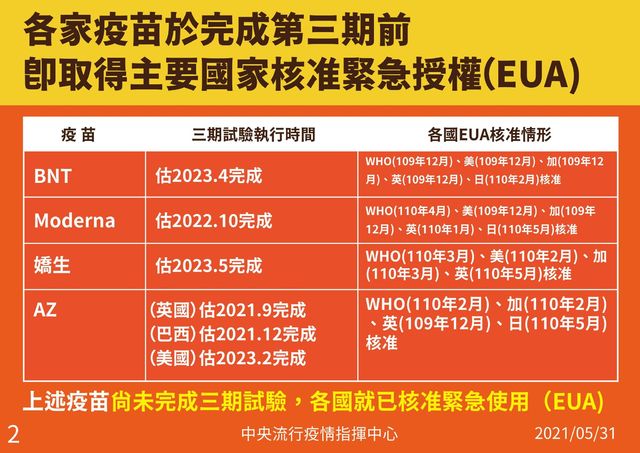
另外,針對各國是否都有做完三期實驗才通過緊急授權(EUA)?陳時中表示,各國三期實驗時間都拉得很長,所以各家疫苗於完成第三期前,即取得主要國家緊急授權,他也坦言,「疫情嚴重的時候,如果大家都等到三期實驗完畢後才做決定,那恐怕真的是緩不濟急」,他也舉例,BNT的三期試驗執行時間估計要等到2023年4月才會完成,但主要國家皆在2020年12月起就通過EUA,其他如嬌生、AZ、莫德納等共4款疫苗,都是尚未完成三期,各國就已經核准緊急使用(EUA)。
新聞來源:華視新聞




















讀者迴響